據韓聯社報導,韓國食品醫藥品安全處(食藥處)23日表示,已附條件批准兩款新冠病毒抗原自檢試劑盒上市。兩款試劑盒分別由醫療器材企業SD BIOSENSOR和HUMASIS研製,此前曾在國內獲准供專家使用,並在海外作為自檢產品獲得緊急使用許可。在德國進行的臨床試驗結果顯示,SD BIOSENSOR自檢試劑盒的靈敏度為82.5%,特異度為100%。在捷克和巴西進行的臨床試驗結果顯示,HUMASIS試劑盒的靈敏度為92.9%,特異度為99%。
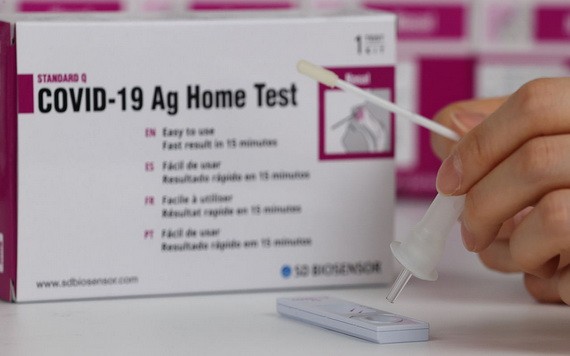 SD BIOSENSOR自檢試劑盒。(圖源:韓聯社)
SD BIOSENSOR自檢試劑盒。(圖源:韓聯社)
用戶可在無需專業人員的幫助下自行使用兩款產品從鼻腔採集檢測樣本進行檢測,15至20分鐘以內便可出結果。但與現有的核酸檢測和鼻拭子檢測方式相比,自檢試劑盒的靈敏度較低。
附條件批准是指在產品正式上市之前,以在3個月內補交臨床試驗資料為條件限時准許使用的制度。食藥處強調,兩款產品均無法為診斷確診提供最終依據,僅可作為輔助手段使用。若檢測結果顯示陽性,必須接受核酸檢測。若顯示陰性,疑似感染或出現相關症狀時也應接受核酸檢測,是否確診應由醫生根據核酸檢測結果和臨床症狀判斷◆





















